Що робить генетик? Медико-генетичне консультування: функції лікаря-генетика
Ви хочете зрозуміти, як на ваш організм впливають шкідливі звички:
- Куріння;
- Алкоголь;
- Вживання в їжу смажених та копчених продуктів;
Ви хочете знати ризик розвитку у вас таких захворювань як:
- Онкологічне захворювання;
- артеріальна гіпертонія;
- Атеросклероз;
- інфаркт;
- Інсульт;
- Схильність до тромбозу;
- Цукровий діабет 1 типу;
- Різні форми жіночої та чоловічої безплідності.
Ви боїтеся раптової смерті від інфаркту, інсульту та тромбоемболій;
Ви починаєте приймати лікарські препарати, але турбуєтеся про можливий розвиток побічних ефектів;
У вашій сім'ї були випадки онкологічних захворювань;
Ви плануєте прийом (або вже приймаєте) оральні контрацептиви і хочете унеможливити ризик індивідуальних наслідків прийому;
Ви хочете стати мамою і плануєте народити здорового спадкоємця, виключивши ризики пов'язані з патологією вагітності, які можуть загрожувати Вам та Вашій майбутній дитині;
У Вас проблеми із зачаттям дитини після року подружнього життя;
Ви пережили викидень або передчасні пологи і хочете зменшити подібні ризики в майбутньому;
Ви не розумієте, чому Ваша новонароджена дитина швидко набирає вагу;
Ви ходите до солярію і хочете зрозуміти, наскільки це захоплення для вас безпечне;
Ви займаєтеся спортом та хочете провести оцінку ризиків, пов'язаних з активним фізичним навантаженням;
Ви готуєтеся до хірургічної операції та хочете знизити ризик можливих ускладнень;
Ви працюєте на небезпечному виробництві та не знаєте, наскільки висока для Вас індивідуальна небезпека онкопатології від контакту з токсинами;
Ви плануєте своє життя, дбаєте про своє здоров'я.
Що вивчає генетика?
Генетика - це науку, яка займається законами та механізмами, як мінливості, так і спадковості. Залежно від того, що саме проходить низка досліджень, ця наука може бути кількох видів - це і генетика людини, і тварин, і рослин, і мікроорганізмів. Крім цього є й інша класифікація цієї науки. Лікар-генетик виконує дві основні функції. По-перше, він "допомагає" колегам "поставити діагноз", використовуючи при диференціальній діагностиці спеціальні генетичні методи, і, по-друге, визначає "прогноз здоров'я майбутнього потомства" (або вже народженого). При цьому завжди перед лікарем виникають лікарські, генетичні та деонтологічні проблеми; на різних етапах консультування переважають то одні, інші. Медико-генетична консультація складається із 4 етапів; діагноз, прогноз, висновок, порада. Консультування починається з уточнення діагнозу спадкової хвороби, оскільки точний діагноз є необхідною передумовою будь-якої консультації. Лікар, перш ніж направити пацієнта в медико- генетичну консультацію, повинен за допомогою доступних йому методів максимально уточнити діагноз та визначити мету консультації. Необхідне застосування генеалогічного, цитогенетичного, біохімічних та інших спеціальних генетичних методів (наприклад, визначити зчеплення генів або використовувати молекулярно-генетичні методи тощо). У таких випадках пацієнта направляють на медико-генетичну консультацію і генетик допомагає лікареві в постановці діагнозу. При цьому може виникнути необхідність спрямування пацієнта чи його родичів на додаткові дослідження.
Як проводитись діагностика спадкових хвороб?
В основі хвороб зі спадковим нахилом лежить взаємодія спадкових і зовнішніх факторів. Складна багатофакторна природа цих захворювань і на цю патологію страждає п'ята частина населення (приблизно 20 відсотків). До неї відносять численні захворювання серцево-судинної, бронхолегеневої, нервової систем, шлунково-кишковий тракт, шкіри та ін. Поява хвороби зі спадковим нахилом більшою мірою залежить від факторів зовнішнього середовища. На даний час проведено досить багато досліджень, що дозволили отримати загальні уявлення про зміни в генах, що привертають до розвитку таких захворювань, як атеросклероз, гіпертонічна хвороба, ішемічна хвороба серця, рак, ендометріоз, бронхіальна астма, виразкова хвороба, цукровий діабет, епілепсія, шизофренія, алкоголізм та інші Мультифакторіальні захворювання можуть виникнути під впливом факторів довкілля у всіх. Однак за наявності спадкової схильності вони розвиваються значно частіше, причому в молодшому віці, і протікають важче. Для практичної медицини має велике значеннявизначення кола осіб, схильних до високого ризику виникнення даної патології. Такі пацієнти повинні перебувати під пильною увагою медиків щодо цілеспрямованої профілактики та розробки індивідуального лікування.
- Клініко-генеалогічний метод
Однією з неодмінних умов правильної та своєчасної діагностики, профілактики та лікування спадкових хвороб, а також визначення генетичного ризику та клінічного прогнозу для родичів хворого є використання клініко-генеалогічного методу. Клініко-генеалогічний метод заснований на аналізі характеру передачі різних ознак та захворювань в окремо взятій сім'ї із зазначенням родинних зв'язківміж членами родоводу. Клініко-генеалогічний метод допомагає поставити правильний діагноз і, отже, вибрати адекватне лікування та своєчасно проводити цілеспрямовані профілактичні заходи. Тому, прямуючи на прийом до лікаря-генетика, подружня пара має бути добре підготовлена. Необхідно з'ясувати стан здоров'я або причину смерті всіх найближчих та віддалених родичів як з боку дружини, так і чоловіка. Бажано знати не тільки дівочі прізвища жінок родоводу, але також вік, а ще краще – дату, місце народження та проживання предків. Так, проживання сімей батьків хворої чи просто консультованої людини у географічно ізольованій місцевості, у близько розташованих районах дозволяє припустити наявність спільних предків, що може сприяти накопиченню більшої кількості однакових генів, допомагає виявити наявність у сім'ї кровноспоріднених шлюбів. Шлюби між близькими родичами збільшують ризик і мають велике значення при розгляді хвороб із спадковою схильністю. Крім того, лікареві-генетику слід розповісти про етнічне походження сім'ї, бо особи різних етнічних груп (наприклад, євреї, узбеки, фіни та ін.) мають підвищену схильність до певних спадкових захворювань. Правильно і точно зібрані дані дають лікарю необхідну інформацію і часто є основою діагностики спадкових захворювань.
- Цитогенетичний метод
Для визначення змін у хромосомному апараті, пов'язаних із неправильним набором Х-хромосом, часто застосовують відносно простий, але досить інформативний метод дослідження статевого хроматину. Для цього роблять шпателем легкий зіскрібок зі слизової внутрішньої поверхні щоки, який наносять на скло. Злущені клітини, що потрапили туди, відповідним чином обробляють і розглядають під мікроскопом. В епітеліальних клітинах жінок зазвичай виявляється одна темна цятка - тільце Барра. У чоловіків, які мають лише одну Х-хромосому, його немає. Відсутнє тільце Барра і у жінок із синдромом Шерешевського-Тернера. За наявності в каріотипі жінки двох додаткових хромосом (при трисомії-Х) у клітинах таких тілець два і т. д. Однак діагноз хромосомного захворювання вважається встановленим лише у випадку, якщо проведено каріологічне обстеження, тобто вивчений каріотип. Визначення каріотипу трудомістке і дороге.
Показаннями для каріотипування є:
- виявлена патологія статевого хроматину;
- наявність у хворого множинних вад розвитку;
- затримка психомовного та розумового розвитку у поєднанні з підвищенням числа мікроаномалій;
- повторні мимовільні аборти, мертвонародження, народження дітей з вадами розвитку, хромосомною патологією (у всіх цих випадках обстежується сімейна пара, тобто обов'язково чоловік та дружина);
- вік вагітної 35 років та старше.
- Біохімічний метод
Біохімічний метод використовується для діагностики спадкових хвороб обміну. Методи біохімічної генетики мають кілька рівнів. Перший етап передбачає обстеження за допомогою недорогих якісних орієнтовних експрес-методик, так званих скринінгових якісних та напівкількісних реакцій із сечею та кров'ю, що дозволяють запідозрити те чи інше захворювання. На другому етапі обстеження проводять за допомогою складних та дорогих кількісних методів для встановлення точного діагнозу спадкового захворювання. При цьому здійснюється кількісне визначення в крові амінокислот, білків-ферментів та ін. Третій етап включає визначення дефектного гена методами молекулярної діагностики.
Що таке медико-генетичне консультування?
Медико-генетичне консультування є одним із видів спеціалізованої медичної допомогиі може кваліфіковано здійснюватись лише лікарем - фахівцем у галузі медичної генетики. Консультація лікаря-генетика необхідна:
- Якщо у пари народилася тяжко хвора або фізично неповноцінна дитина
- Якщо у сім'ї серед родичів повторюються випадки спадкової патології
- Якщо подружжя перебуває у кревній спорідненості
- Якщо при плануванні вагітності вік жінки молодше 18 років або старше 35 років. В цьому випадку ймовірність появи мутацій у статевих клітинах батьків, "перетворення" нормальних генів на патологічні досить висока
- Якщо у жінки є первинна аменорея, особливо у поєднанні з недорозвиненням вторинних статевих ознак
- Якщо у жінки відзначається первинна безплідність, наявність диспластичних рис розвитку у поєднанні з іншими патологічними ознаками (наприклад, низьке зростання, судомний синдром тощо)
- Якщо один із подружжя працює на шкідливому виробництві
- Якщо є нестерпність лікарських препаратівта харчових продуктів
- Якщо раніше у жінки були несприятливі результати вагітності: мимовільний викидень, вагітність, що не розвивається, мертвіння
- Якщо за справжньої вагітності жінка перенесла гостре інфекційне захворюванняабо загострення хронічного захворювання; приймала лікарські препарати, алкоголь, наркотики; проводилось рентгенодіагностичне дослідження
- Якщо при справжній вагітності виявлено відхилення у показаннях УЗД; біохімічні маркери патології плода – АФП (альфа-фетопротеїн); ХГЛ (хоріонічний гонадотропін), НЕ – (некон'югований естріол), аналізи на інфекції
Чи народиться дитина здоровою?
Відповідь це питання пацієнтка зазвичай отримує від свого акушера-гинеколога. Однак трапляються ситуації, коли акушер-гінеколог не має можливості досить коректно роз'яснити ситуацію, що склалася. Дорогі жінки, не потрібно вимагати від гінеколога вирішення та роз'яснення питань, що не належать до його компетенції. Спадкові захворювання, у яких трапляються викидні, мертвонародження чи народження неповноцінних дітей - це прерогатива лікаря-генетика, якого вас направляє ваш акушер-гінеколог уточнення діагнозу, тобто. для отримання висновку суміжного фахівця, який є роз'ясненням вашої ситуації самому лікареві. Звичайно, іноді акушер-гінеколог за освітою може бути генетиком з досвіду роботи, і йому нескладно провести диференціальний діагноз з урахуванням клінічного поліморфізму та генетичної гетерогенності спадкової хвороби. Але це трапляється досить рідко, тому в більшості найпростіших випадків акушер-гінеколог може визначити прогноз, але складніші випадки вимагають розгляду лікаря-генетика. Успіхи, досягнуті медичною генетикою, дозволяють проводити комплекс медико-генетичної профілактики уродженої патологіїу двох напрямках:
- Генотипове напрям включає комплекс заходів, вкладених у запобігання передачі мутантного гена чи хромосомної мутації у низці поколінь, тобто. від батьків – дітям. Основним підходом у цьому напрямку є медико-генетичне консультування сімей, обтяжених спадковими хворобами з використанням методів пренатальної діагностики, що дозволяють провести передімплантаційний (на рівні яйцеклітини і сперматозоїда) або внутрішньоутробний відбір генетично дефектних плодів та їх елімінацію з елімінацією.
- Фенотипове спрямування - це комплекс заходів, що запобігають клінічному розвитку хвороби, що знижують тяжкість її прояву, без усунення етіологічного фактора (без усунення причини). Одним із реалізованих у цьому напрямку підходом є проведення профілактичного патогенетичного лікування за деяких хвороб обміну. Як приклад такого підходу є доклінічний скринінг новонароджених (неонатальний скринінг) на фенілкетонурію та вроджений гіпотиреоз та проведення у виявлених дітей патогенетичного лікування.
В даний час пріоритетним національним проектом "Здоров'я" передбачено проведення неонатального скринінгу – масового обстеження новонароджених дітей для виявлення п'яти найбільш поширених уроджених та спадкових захворювань, що ведуть до інвалідизації – фенілкетонурії, вродженого гіпотиреозу, адреногенітального синдрому, муковісциду. Неонатальний скриніг проводиться в пологовому будинку шляхом забору крапельки крові новонародженого на спеціальний тест-бланк, який прямує до медико-генетичної консультації для проведення дослідження. У разі виявлення в крові дитини маркера захворювання батьки з новонародженою дитиною запрошуються до медико-генетичної консультації для проведення повторного дослідження крові, для підтвердження діагнозу та призначення лікування. Надалі ведеться динамічний нагляд дитиною. Генотипний напрямок медико-генетичної профілактики вродженої патології. Головна мета в цьому випадку генетичного консультування – попередження народження хворої дитини. Це стосується насамперед жорстко генетично детермінованих і погано піддаються лікуванню важких вад розвитку та хвороб, що призводять до фізичної чи психічної неповноцінності. Відповідно з цією метою генетик визначає прогноз здоров'я для майбутньої дитини в сім'ї, де був, є або передбачається хворий зі спадковою патологією і роз'яснює батькам ймовірність народження хворої дитини у них. Однак подібні консультації щодо прогнозу здоров'я потомства можуть бути не тільки проспективними, коли ризик народження хворої дитини визначається ще до настання вагітності або на її ранніх термінах, але й ретроспективними, коли проводиться консультування після народження хворої дитини з метою оцінки здоров'я майбутніх дітей. Головною умовою при розрахунку генетичного ризику є точний діагноз, тому так необхідно цитогенетичний висновок, отриманий на другому рівні пренатальної діагностики. За відсутності такого висновку генетичний ризик оцінюється згідно з емпіричними даними та теоретичними розрахунками, що ґрунтуються на генетичних закономірностях.
Консультація лікаря-генетика, як і будь-якого профілю, складається з декількох етапів.
- Перший етап консультування розпочинається з уточнення діагнозу хвороби. Це потребує тісного контакту між генетиком і лікарем-фахівцем у галузі тієї сімейної патології, яка стала предметом консультування (акушер, педіатр, невропатолог чи ін.), т.к. вихідним моментом діагностики є клінічний діагноз. Надалі лікар-генетик уточнює діагноз за допомогою генетичних аналізів, які використовують генеалогічні, цитогенетичні, спеціальні біохімічні методи, розроблені для діагностики спадкових хвороб. Іноді генетичні методи мають вирішальне значення в діагностиці, наприклад, при хворобі Дауна, багатьох вроджених вад розвитку, визначенні причин безплідності, деяких видах патології ознак статі. У цих випадках дослідження каріотипу хворого та його батьків стає обов'язковим елементомдіагностики
 При багатьох спадкових хворобах, наприклад, при геморагічних діатезах, певне значення мають дані, одержані генеалогічним та біохімічним методами. Генетичні методи діагностики дозволяють розрізнити серед близьких по клініці нозологічних форм домінантні, рецесивні, аутосомні та зчеплені зі статтю. Встановлення типу успадкування має вирішальне значення при розрахунку ризику народження хворої дитини. Знаючи тип успадкування, генетик у ряді випадків може точно встановити, що член сім'ї, що консультується, не є носієм патологічного гена, і тим самим усунути його невиправдані підозри. Генетичні методи диференціальної діагностикинерідко мають значення і для клініциста, допомагаючи розшифрувати патогенез хвороби, наприклад, при хромосомних хворобах і ферментопатіях. Для встановлення типу успадкування сімейної патології генетик складає родовід сім'ї з використанням умовних знаків (наприклад, жінка – позначається кружальцем, чоловік – квадратом). Необхідно найбільш повно, не приховуючи, надати генетику необхідні дані, в тому числі і про родичів по висхідній і низхідній лініях, особливо щодо того чоловіка, в якому спостерігалася сімейна патологія. Детально складений родовід дозволяє не тільки встановити тип успадкування патології в цій сім'ї, але й з'ясувати генотипи деяких родичів.
При багатьох спадкових хворобах, наприклад, при геморагічних діатезах, певне значення мають дані, одержані генеалогічним та біохімічним методами. Генетичні методи діагностики дозволяють розрізнити серед близьких по клініці нозологічних форм домінантні, рецесивні, аутосомні та зчеплені зі статтю. Встановлення типу успадкування має вирішальне значення при розрахунку ризику народження хворої дитини. Знаючи тип успадкування, генетик у ряді випадків може точно встановити, що член сім'ї, що консультується, не є носієм патологічного гена, і тим самим усунути його невиправдані підозри. Генетичні методи диференціальної діагностикинерідко мають значення і для клініциста, допомагаючи розшифрувати патогенез хвороби, наприклад, при хромосомних хворобах і ферментопатіях. Для встановлення типу успадкування сімейної патології генетик складає родовід сім'ї з використанням умовних знаків (наприклад, жінка – позначається кружальцем, чоловік – квадратом). Необхідно найбільш повно, не приховуючи, надати генетику необхідні дані, в тому числі і про родичів по висхідній і низхідній лініях, особливо щодо того чоловіка, в якому спостерігалася сімейна патологія. Детально складений родовід дозволяє не тільки встановити тип успадкування патології в цій сім'ї, але й з'ясувати генотипи деяких родичів.
- На другому етапі консультування завдання лікаря-генетика полягає у визначенні ризику народження хворої дитини. Вихідним моментом служить родовід обстежуваної сім'ї. При її аналізі можливі 4 ситуації, що вимагають різного підходу:
- Перша ситуація - моногенно успадкована патологія, коли він повторність хвороби серед родичів дає можливість з'ясувати тип успадкування у цій сім'ї. У цих випадках при прогнозуванні використовують методи теорії ймовірностей та обчислюють теоретичний ризик народження хворої дитини.
- Друга ситуація – полігенно успадкована патологія. Хвороба хоч і повторюється серед родичів, але методи теоретичного розрахунку непридатні та ризик встановлюється на основі емпіричних даних.
- Третя ситуація – хромосомні хвороби, які в окремих випадках можуть повторюватися у потомства подружньої пари.
- Четверта ситуація – спорадичні випадки патології. Найчастіше це випадок народження хворої дитини у здорових батьків, при якому родоводу не вдається знайти даних про патологію серед родичів. У такій ситуації фахівець завжди дуже обережний в оцінці ризику.
Лікар-генетик у кожному конкретному випадку моделює генетичну ситуацію та відносить її до певного типу, що дозволяє сформувати та вирішити завдання з розрахунку ризику.
- На третьому етапі консультування лікар-генетик виносить висновок про ступінь ризику виникнення хвороби у дітей подружжя, що консультується, і дає батькам відповідні рекомендації. Відповідальність лікаря, який розрахував ризик, дуже велика. Від його поради залежить попередження пологів або народження дитини, приреченої при сучасному рівнімедицини на важкий фізичний дефект чи психічну неповноцінність. Необґрунтовані рекомендації можуть принести страждання дитині та нещастя сім'ї. На батьків ляже величезне горе від безсилля допомогти хворій дитині. Саме тому рада лікаря-генетика ґрунтується на точних розрахунках ймовірності народження хворої дитини за існуючої в сім'ї генетичної ситуації. Особисті враження лікаря тут неприпустимі! Суцільна математика та тільки!
- Висновок лікар-генетик оформляє у письмовій формі з огляду на тяжкість сімейної патології, величину ризику народження хворої дитини та морально-етичну сторону питання. Заключний етап консультування – рада лікаря-генетика – не менш відповідальний етап, що вимагає найуважнішого відношення.
Багато консультованих пар не підготовлені до сприйняття генетичної інформації. Всі, хто звертається до консультації, хочуть мати дитину і чекають від консультанта на позитивну відповідь. Нерідко їхні запити нереальні, оскільки вони не знають про можливості консультанта-генетика та очікують від нього практичної допомоги.
В інших випадках подружжя хоче перевірити позитивні прогнози, засновані на оповіданнях знайомих, або почувається винними перед своїм чоловіком чи дружиною. Усе це збільшує відповідальність лікаря-генетика: кожне слово інтерпретується у бажаному напрямі. Якщо подружжя сильно побоюється мати хвору дитину, то необережне слово лікаря посилює страх, хоча насправді ризик може бути невеликим. Навпаки, іноді бажання мати дитину настільки велике, що навіть за високого ризику подружжя вирішує народити його, тому що лікар сказав про деяку ймовірність, що він буде здоровим. Тому якщо досягнуто взаєморозуміння між лікарем-генетиком та особами, які приходять на консультацію, можна сподіватися на її успіх. Консультант-генетик завжди враховує мотиви, якими можуть керуватися люди (емоційні, соціально-економічні та інші), які звернулися за консультацією. Проте висновок лікаря-генетика завжди об'єктивно, хоч і "ситуаційно", тобто. генетичний ризик оцінюється з урахуванням тяжкості перебігу хвороби, тривалості життя, можливості лікування та внутрішньоутробної діагностики. У відповідях подружжю не враховується їхнє бажання мати дитину. Лише об'єктивні дані! Необґрунтовано сприятлива рада може обернутися тяжкою психічною травмою після народження хворої дитини. Гірка правда краще за приємну брехню. Надалі сім'я самостійно приймає прийнятне нею рішення.
Яке лікування спадкових хвороб?
Лікування спадкових захворювань дуже важко, тривалий час і, слід чесно сказати, часто малоефективне. Відомі три основні напрями терапії: пряма спроба «виправлення» зміненого гена, вплив на основні механізми розвитку захворювання та, нарешті, лікування окремих симптомів, які є у хворого.
«Виправлення» дефектів генів, можливе лише за допомогою методів генної інженерії, під якою розуміють вбудовування в геном клітини нормальних, недефектних генів, що здійснюють ту саму функцію. Спочатку генотерапія була розроблена для лікування та профілактики моногенних спадкових захворювань. Однак за останні роки акцент змістився у бік більш поширених хвороб – раку, серцево-судинної патології, СНІДу (синдрому набутого імунодефіциту) та ін.
При ряді спадкових захворювань розроблено різноманітні лікувальні дієти, що дозволяють за допомогою виключення або обмеження певних речовин у раціоні домогтися нормального психічного, фізичного розвитку дітей та попередження прогресування обмінних порушень. Так, розроблено спеціальну дієтотерапію при фенілкетонурії та інших спадкових захворюваннях обміну амінокислот, галактоземії, фруктоземії (непереносимість вуглеводу фруктози). Враховуючи, що дія патологічних генів здійснюється постійно, лікування таких хворих має бути тривалим, іноді протягом усього життя. Таке лікування потребує постійного біохімічного контролю та лікарського спостереження. У ряді випадків застосовується замісна терапія гормонами (наприклад, інсуліном при цукровому діабеті), безпосередньо ферментами (при хворобі Гоше та ін.). При деяких спадкових захворюваннях проводиться «чистка» організму шляхом призначення спеціальних препаратів, що виводять шкідливі продукти обміну, а також проведення очищення крові (гемосорбції), плазми (плазмофорез), лімфи (лімфосорбція) та ін. хірургічне лікування- Корекція деформацій.
Генетик - це медичний фахівець, який вивчає спадкові захворювання. Кабінет лікаря – генетика потрібно відвідати ще до планування вагітності. Якщо подружня пара не зробила візит до лікаря заздалегідь, то майбутнім батькам варто звернутися на прийом обов'язково, особливо у випадках можливого ризику народження дитини зі спадковими захворюваннями.
Випадки, коли консультації лікаря генетика є обов'язковими.
Назвемо кілька причин, з яких лікар акушер-гінеколог видає направлення на обстеження вагітної генетика:
1. Якщо попередня дитина народилася зі спадковими захворюваннями чи вадами розвитку.
2. Якщо в одного з подружжя є спадкове захворювання або вада розвитку.
3. Якщо у віці батька старше 40 років або .
4. При кровноспоріднених шлюбах.
5. Негативний вплив довкілляу ранніх термінах вагітності.
6. Прийом на ранніх термінах вагітності.
7. При ранніх термінах і переривання вагітності.
8. При випадках мертвонародження, мимовільних викиднів.
Маючи отримані результати, пройдених аналізів, і після співбесіди з молодою парою, лікар-генетик встановлює рівень генетичного ризику безпосередньо кожної сімейної пари. Генетичний ризик – це ймовірність прояву певних спадкових захворювань у сімейної пари чи генетичних патологій у плода. Можливість ризику обчислюється з урахуванням даних аналізів і основі аналізу генетичних закономірностей. Можливість точно визначити наявність генетичного ризику залежить від повноти та достовірності генеалогічних даних (даних про подружжя та їх родичів) та від точності діагнозу. Тому сімейна пара, спрямована до лікаря-генетика, має ретельно підготуватися до консультації, обов'язково згадати, на які спадкові захворювання хворіли родичі дружини та чоловіка.
Найнижчий генетичний ризик вважається до 5%. Ризик від 6 до 20% - середній, та подружній парі рекомендується пройти метод «пренатальної діагностики». У випадках високого ризикуБільше 20% проходження майбутнім батькам методу «пренатальної діагностики» є обов'язковим.
Методи дослідження вагітної у генетика
При консультуванні лікар-генетик використовується різноманітні методи обстеження вагітної та її родичів, які залежать від їхніх спадкових захворювань. Основними є клініко-генеалогічні, цитогенетичні, біохімічні, молекулярно-генетичні (ДНК-аналіз), імунологічні дослідження та методи пренатальної діагностики.
Клініко-генеалогічний метод - метод збору та аналізу родоводу, який дозволяє дізнатися інформацію, необхідну для встановлення причин захворювання та постановки діагнозу.
Цитогенетичний метод використовують щодо хромосомного набору людини (каріотипу). Дослідження каріотипу проводять жінкам, які страждають на відсутність менструацій (первинною аменореєю), жінкам з невиношуванням вагітності, які мають раннє мертвонароджених або померлих з неясних причин дітей у ранньому віці, батькам, які вже мають дітей з розумовою відсталістю або вадами розвитку.
Методи пренатальної діагностики сприяють постановці однозначного прогнозу генетичної патології плода і підвищують ефективність генетичного консультування. З методів пренатальної діагностики застосовують дві групи: неінвазивні та інвазивні.
Чи не хірургічні методи пренатальної діагностики (неінвазивні) можуть бути використані для обстеження всіх вагітних. До них відносяться: ультразвукове дослідження у І та ІІ триместрах вагітності, визначення хоріонічного гонадотропіну, альфа-фетопротеїну та некон'югованого естріолу у сироватці крові матері у ІІ триместрі вагітності, визначення внутрішньоутробного інфікування.
Важливе місце у неінвазивній діагностиці віддається ультразвуковому дослідженню (УЗД). Спостерігається прямий взаємозв'язок між видом пороку та терміном його виявлення методом УЗД. Деякі вади розвитку піддаються діагностики лише наприкінці І – на початку ІІ триместру вагітності. Наприклад, вади головного мозку, нерозділені плоди, полікістоз нирок, грижі черевної стінки, спинномозкові або черепно-мозкові грижі та ін. 3 рази протягом всієї вагітності (10-12, 20-22 і 30-32 тижнів), а за необхідності, наприклад, при підозрі на порок розвитку - через кожні 3-4 тижні. Точність діагностики вад розвитку до кінця II триместру вагітності наближається до 100%. Точність діагностики у групі підвищеного ризику становить 90%, уроджених вад плода – 87%.
До неінвазивної діагностики належать методи визначення біологічно активних речовин, що виробляються плацентою у сироватці крові (наприклад, альфа-фетопротеїну). Проводять такі аналізи на 16-20 тижні вагітності. У випадках зміни вмісту альфа-фетопротеїну в сироватці крові, говорять про можливий ризик виникнення хромосомної патології, розвиток пороку нервової системиплода (ущелини спинного мозку або аненцефалія – відсутність головного мозку). Будь-який із даних діагнозів обов'язково уточнюється за допомогою УЗД.
Для хірургічних методів (інвазивних) беруть кілька клітин плода щодо аналізів.
На ранніх термінах вагітності застосовують біопсію хоріону, з якого формується плацента. З цією метою роблять прокол передньої черевної стінки плодового міхура і дістають невелику ділянку хоріону. Для аналізу оптимальний термін 8-11 тижнів вагітності.
Аналіз тканини хоріону проводять у таких випадках:
1. Зміна хромосомного набору (каріотипу) в одного з батьків,
2. Наявність у сім'ї дитини з хромосомною патологією, порушеннями обміну речовин, зчепленими зі статтю захворюваннями (наприклад, гемофілією), гемоглобінопатіями.
3. При віці матері старше 35 років.
У деяких випадках (наприклад, у ІІ триместрі вагітності) для діагностики беруть тканину плаценти методом плацентоцентезу (аналіз схожий на біопсію хоріону). Показання до проведення методу плацентоцентезу самі, як і до біопсії хоріона.
Паркан та аналіз навколоплідних вод(амніоцентез) у II триместрі вагітності, як метод пренатальної діагностики, найбільш віддаємо перевагу. Бажаний термін для його проведення – це 17-20 тижнів вагітності. Досліджуючи амніотичну рідину можна встановити рівень вмісту різних гормонів та ферментів, альфа-фетопротеїну, каріотип плода. Провівши аналіз ДНК, можливо, діагностувати деякі наслідувані, зчеплені зі статтю та аутосомно-рецесивні захворювання, хромосомну патологію плода, багато вад розвитку центральної нервової системи.
Досліджуючи (кордоцентез) встановлюють спадкові хвороби крові, імунодефіцитні стани, обмінні порушення, внутрішньоутробне інфікування плода, визначають каріотип (хромосомний набір) плода. Аналіз проводять починаючи з 17 тижня вагітності.
У ІІ триместрі вагітності також можлива біопсія шкіри плода з метою діагностики можливих захворювань шкіри.
Однак, ще в I триместрі вагітності, але не раніше п'яти тижнів після зачаття, можливе проведення ембріоскопії (від грец. embryon – зародок, skopeo – дивлюся). Для цього використовують спеціальний волоконно-оптичний ендоскоп (гнучкі оптичні волокна), які вводяться в шийку матки. Таким методом оцінюють кровообіг плода, а також безпосередньо спостерігають стан ембріона для діагностування. можливих порушеньйого розвитку.
Як недолік інвазивних методів діагностики можна назвати можливе виникнення різноманітних ускладнень, до переривання вагітності. У зв'язку з цим лікар-генетик рекомендує їх лише у випадках високого ризику виникнення генетичної патології плода.
Хто такий лікар-генетик
Читайте також:
Наука генетика – це галузь медицини, яка вивчає закономірності спадковості та зміни людини. Генетик – лікар, який досліджує механізми передачі різних захворюваньвід покоління до покоління. Патологія має закономірності, наприклад, носії певного гена не завжди означає наявність у них хвороби. До генетика бажано звертатись у разі планування вагітності для визначення у батьків можливих спадкових захворювань хромосомних перебудов. Також слід звернутися під час встановлення вагітності, щоб виявити ряд патологій, раннє діагностування яких може призвести до переривання за медичними показниками. Лікар-генетик - спеціальність, затребувана у всьому світі, адже 5% дітей з'являються з вродженими захворюваннями, до яких належать синдром Дауна, гемофілія, дальтонізм, вивих стегна, спина Біфіда та ін.
Компетенція лікаря-генетика
Лікар-генетик займається:
- Визначенням типу успадкування певної сім'ї (три покоління).
- По можливості встановлення точного діагнозу.
- Вивчення ризику повторення захворювань.
- Визначенням ефективного методу профілактики.
- Детальним та доступним поясненням членам сім'ї, які звернулися по допомогу.
У яких ситуаціях слід звертатися до лікаря-генетика
Необхідно проконсультуватися у лікаря цієї спеціальності під час планування вагітності. Особливо це стосується таких пар:
- Подружжю, які мають проблему безпліддя.
- Жінкам, які перенесли дві вагітності, що не розвинулися.
- Коли є випадки мимовільних викиднів.
- Якщо виявлено за умов сім'ї спадкові захворювання.
- Коли вік жінки перевищив 35 років.
- Якщо під час вагітності планового УЗ-скринінгу було виявлено вади розвитку плода.
Дитині генетика може знадобитися визначення хромосомної чи спадкової її хвороби. Відвідати лікаря слід, якщо у малюка помічено порушення психомовного чи фізичного розвитку, є ЗПР, уроджені вади, або аутистичні розлади. Метою консультації генетика є виявлення вад розвитку та хвороб, а також профілактика спадкових захворювань.
Причинами звернення до генетика є також:
- Безпліддя первинне та первинне не виношування вагітності.
- Викидня або народження мертвого плода.
- Якщо в сімейному анамнезі є спадкові або вроджені хвороби, що змінилися.
- Під час укладання шлюбу між близькими родичами.
- Планування процедури ІКСІ та ЕКЗ.
- Хід вагітності з ризиком хромосомної патології.
- На підставі результатів УЗД ймовірність вродженої вади розвитку.
- Якщо на перебіг вагітності був вплив негативних факторів, прийом лікарських засобів, перенесена на ГРВІ та професійні шкідливості.
Які органи перебувають у компетенції лікаря-генетика

Генетик займається лікуванням окремих органів, а встановлює природу хвороби генетичного виду.
Які захворювання досліджує лікар-генетик
Генетик займається такими хворобами:
- Адреногенітальний синдром, аксіомами медичної генетики.
- Хворобами з аутосомно-домінантним та аутосомно-рецесивним типами успадкування.
- Хворобами з Х-зчепленим домінантним типом спадкування.
- Генетикою людини, клінічною та медичною.
- Генетичною класифікацією спадкових хвороб.
- Геномікою патогенних бактерій та вірусів, а також євгенікою.
- Значення генетики для медицини, клінічною діагностикоюспадкових захворювань.
- Синдромом мікроцитогенетичним.
- Міодістрофіей Дюшенна-Беккера.
- Дистрофія міотонічної (дистрофія міотонія, хвороба Штейнера).
- Мітохондріальною спадковістю, муковісцидозом, мутаціями.
- Спадковою схильністю до алкоголізму.
- Спадковістю, нейрофіброматозом 1-го типу.
- Особливостями клініки спадкової патології, сімейною гіперхолестеринемією.
- Синдром Вольфа-Хіршхорна, Дауна (трисомія 21), дисомії по Y-хромосомі.
- Синдром Клайнфелтера, котячого крику, Марфана, Патау (трисомія 13).
- Синдром трипло-Х (47, ХХХ).
- Синдром розумової відсталості з ламкою Х-хромосомою.
- Синдром часткової трисомії по короткому плечу хромосоми 9.
- Синдромом Шерешевського-Тернера, Едвардса (Трісомія 18), Елерса-Данло.
- Упорядкуванням родоводу, трисомією 8.
- Чинниками підвищеного ризику народження дітей із хромосомними захворюваннями.
- Фармакогенетикою, фенілкетонурією.
Лабораторні аналізи та діагностика, які може призначити лікар-генетик
Генетики у дослідженні використовують складні методи діагностування, серед яких:
- Генеалогічний метод, спрямований збір інформації про захворювання родичів щонайменше 3-х поколінь.
- HLA-тестування чи вивчення генетичної сумісності. Метод рекомендується для подружжя, яке планує вагітність.
- Преимплационное вивчення генетичних відхилень ембріонів, одержаних при ЕКЗ.
- Комбінований неінвазивний скринінг сироваткових маркерів плода та жінки. Метод дозволяє виявити хромосомні патології на етапі виношування дитини.
- При гострої потребивикористовуються інвазивні методи діагностики плода. Матеріал плодовий генетичний одержують за допомогою біопсії хоріону, амніоцентезу або кордоцентезу.
- Ультразвукове дослідженнядозволяє побачити дефекти та аномалії розвитку плода. При виношуванні дитини її проводять тричі.
- Біохімічний скринінг проводять всім вагітним. Метод дозволяє виключити хромосомні аномалії (синдром Патау, Дауна, Едвардса та ін.).
- Скринінг новонароджених виконується для виявлення галактоземії, муковісцидозу, фенілкетонурії, гіпотиреозу вродженого та андрогенітального синдрому. Якщо хвороби виявили, процедуру повторюють на підтвердження, і призначається відповідне лікування.
Генетик також здатний встановити материнство та батьківство, а також спорідненість біологічну.
Що відбувається на прийомі у генетика

Консультація генетика складається з кількох етапів:
- Уточнюється діагноз. Спадкова патологія потребує різних методів дослідження для підтвердження або заперечення захворювання (імунологічне, біохімічне, генеалогічне, цитогенетичне та ін.). Іноді потрібно детальніше вивчення родичів хворого.
- Генетик пояснює природу виявленого захворювання. Прогноз будується на визначенні типу спадкування (хромосомне, моногенне, мультифікаторне).
- У письмовій формі видається пацієнтам висновок із зазначенням прогнозу здоров'я для потомства у кожному даному випадку. Лікар інформує батьків про появу хворої дитини.
- Рішення про народження дитини приймає подружжя, але вони поінформовані генетиком про появу дитини з урахуванням тяжкості хвороби та тривалості її життя, а також про ризики для малюка та батьків.
Сприятливий час для зачаття потомства - це кінець літа та початок осінь. При цьому слід більше гуляти, вживати продукти, збагачені вітамінами, макро- та мікроелементами, уникати вірусних інфекцій.
Для народження здорового потомства необхідно враховувати, що найсприятливіший вік від 18 до 35 років. Якщо жінка народжує після 35-річного віку, перед зачаттям рекомендується пройти дослідження генетика.
Період для зустрічі та консультації з генетиком - це час до планування вагітності та укладення шлюбу у разі сімейних пар із близькою спорідненістю. Якщо жінка вже вагітна, генетик запропонує провести пренатальні тести та допоможе ухвалити рішення народжувати дітей чи ні в індивідуальному порядку.
Поради генетиків врятували багато тисяч пар, які мають високий ризик народження дітей, уражені вадами розвитку різної форми захворювання.
Генетика – це наука про закономірності спадковості та мінливості. Нині генетика грає одну з найважливіших ролей у медицині, а й сільське господарство.
Хто такий генетик?
Генетик – це медичний фахівець, який займається діагностикою, лікуванням та профілактикою патологічних процесів, зумовлених спадковою схильністю. Найчастіше люди звертаються за консультацією до генетика на стадії планування дитини або в тому випадку, якщо у людини підозрюється якесь спадкове захворювання.
У тому випадку, якщо пара кровноспоріднена і планує або вже зачала дитину, консультація та спостереження генетика просто обов'язкова.
Що входить до компетенції генетика?
Усі захворювання, які можуть бути зумовлені спадковою схильністю або спричинені зв'язком між близькими родичами, підпадають під компетенцію лікаря-генетика.
Крім цього, генетик може розрахувати ступінь ризику розвитку того чи іншого захворювання у дитини, за умови, що носієм є обидва батьки або один із них. У такому разі лікар обов'язково проводить бесіду з батьками, пояснюючи їм усі фактори, ризики та розвиток патологічного процесу надалі.
Слід зазначити, що лікар-генетик не лікує будь-який один орган. Фахівець працює над виявленням хвороби загалом, що стосується всього організму.
Які хвороби лікує генетик?
У сфері компетенції цього фахівця лежить дуже багато патологічних процесів. Деякі їх зустрічаються вкрай рідко. До найпоширеніших можна віднести такі недуги:
- патології, які мають домінантний, рецесивний Х-зчеплений тип успадкування;
- геноміка;
- синдроми різного типу( , Дисомії, котячого крику);
- розумова відсталість;
- схильність малюка генетично до алкоголізму, споживання наркотичних засобів, нікотину;
- мутації різного типу.
Крім цього, лікар-генетик може скласти родовід і прорахувати ступінь ризику розвитку будь-якого генетичного захворювання у дитини на стадії зачаття.
Коли потрібно звертатись до генетика?
Консультація цього фахівця обов'язкова на стадії планування дитини, за умови, що були випадки тяжких спадкових патологій. Особливо, на це слід звернути увагу, якщо в сім'ї вже народилася дитина, з якоюсь генетичною хворобоючи з патологією невідомої етіології.
Проте слід зазначити і те, що консультація генетика не буде зайвою навіть у тому випадку, якщо для занепокоєння немає видимих причин. За допомогою сучасних діагностичних методів серйозну патологію можна виявити на стадії першого триместру вагітності. Похід до генетика обов'язковий у тому випадку, якщо на УЗД було виявлено відхилення у розвитку плода.
Потрібно взяти до уваги й той факт, що діагноз фахівця не завжди можна розглядати як вирок. Багато патологічних процесів, навіть зі спадковою схильністю, можна коригувати або зводити їхню дію до мінімуму.
Також до генетика потрібно звертатися, якщо справедливі такі фактори:
- у жінки народжуються лише мертві діти або вагітність закінчується викиднем;
- у сімейній парі, де жінці 35 років та більше;
- людина, яка має схильність до генетичних захворювань та планує дитину;
- люди, у яких спостерігається патологічне погіршення розумової діяльності із віком;
- пари, які є кровними родичами.
Принцип роботи генетика
Робота лікаря з пацієнтами починається із з'ясування сімейного анамнезу. Щоб виключити етіологічні чинники іншої форми, спочатку пацієнт проходить обстеження у певних фахівців.
Тільки після того, як лікар-генетик матиме результати обстеження та повний сімейний анамнез, призначається програма діагностики.
Методи генетичних досліджень
У своїй роботі фахівець використовує такі методи діагностики:
- скринінг генетичного типу;
- ДНК-діагностика;
- дослідження хромосом;
- каріотип.
Якщо йдеться про патологію плода, то призначаються додаткові методи досліджень:
- біопсія матеріалу із матки;
- біохімічний маркер матері;
Що стосується інвазивних методів, то такі призначаються тільки в крайніх випадках. Зумовлено це тим, що такі інструментальні аналізи можуть зашкодити здоров'ю дитини.
Своєчасне звернення пари до цього фахівця може допомогти запобігти розвитку тяжкої патології у дитини на ранній стадіїрозвитку плода. Правильне планування малюка дає можливість якщо не виключити, то мінімізувати ризик розвитку важких недуг і ускладнень. Останнє стосується не тільки самої дитини, а й її мами. Слід зазначити і те, що, в цьому випадку, йдеться не лише про фізичне здоров'ямалюка та батьків, а й про психологічне.
Завідувач лабораторії функціональної геноміки Медико-генетичного наукового центру Михайло Скоблов розповів, до чого в результаті приведуть дослідження в галузі медичної генетики і чому перша «відредагована» людина, швидше за все, народиться у Китаї.
Почну з того, що коротко розповім про себе. Я більше десяти років працюю в Медико-генетичному науковому центрі, який займається генетичними захворюваннями людини – тим, як вони влаштовані, які їх причини – та розробляє різні підходи для їхньої діагностики та лікування. Також я працюю в Московському фізико-технічному інституті, де створено добрі умови для занять наукою. У МФТІ мене насамперед цікавлять студенти – талановиті хлопці, які вже зараз можуть стати учасниками наукового процесу, зокрема, допомагати обробляти величезну кількість даних, які продовжують накопичуватись у галузі біології та медичної генетики.
А що ж це таке – медична генетика? Одне з найпростіших пояснень: це наука, що займається з'ясуванням ролі генів у виникненні патологій у людини. Як відомо зі шкільного курсу, вся генетика пішла від Менделя (Грегор Йоган Мендель – австрійський ботанік, монах-августинець, основоположник вчення про спадковість. Род.); так от, ті ж самі класичні закони наслідування, їм прописані, лежать і в основі сучасної медичної генетики.
Почнемо зі спадкових хвороб. Я розповім, як їх знаходили, як описували, як вивчали. Взагалі, це досить складне питання. Вичленувати генетичні захворювання довгий часне вдавалося. Це зовсім не просте завдання. Але основним наріжним каменем у медичній генетиці є успадкування захворювань. І в основі цього лежить так званий родовід сім'ї хворого.
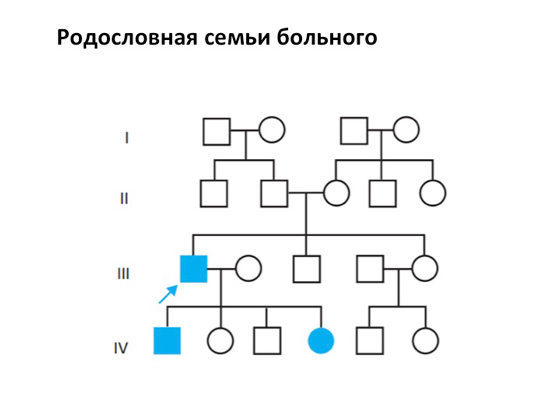
Квадратиками в таких «родоводів» завжди позначаються особи чоловічої статі, кружальцями – обличчя жіночої статі. Ось у них утворюються діти, які теж можуть давати потомство, і таке інше. І ось у якомусь поколінні виникає один хворий член сім'ї, і зрозуміло, що його хвороба може успадковуватися. І тут виникає та сама генетична компонента, яку можна вичленувати, розписати, з нею медична генетика вже може починати працювати.
Найперше вичленування генетичної компоненти відбулося відносно недавно - 1966 року. Був такий учений Віктор Алмон Макк'юсік, який створив каталог аутосомно-домінантних, аутосомно-рецесивних та Х-зчеплених фенотипів (тобто те, як люди виглядають, як у них проявляються захворювання). І з того часу весь світ займається дослідженнями та збиранням інформації про те, як виглядають генетичні захворювання, як вони влаштовані. На сьогоднішній день їх описано дуже багато – понад вісім тисяч. Існує онлайн-база даних OMIM (Online Mendelian Inheritance in Man), в якій будь-який вчений, якщо він провів грамотне дослідження, може залишити запис, тим самим збагативши науку.
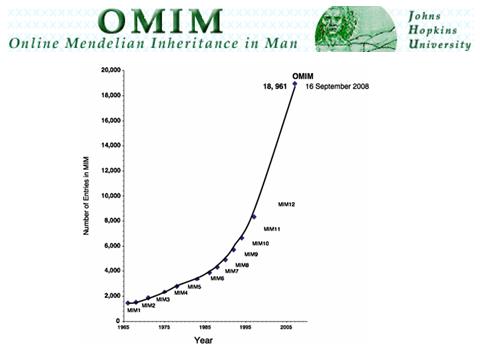
Якісь захворювання відомі дуже добре – ми знаємо їх молекулярні основи та розуміємо, з чого вони походять. Для якихось все ще не вистачає інформації. А про якісь хвороби поки що лише передбачається, що вони можуть бути генетичними. Але це найважливіша основа медичної генетики: ми маємо опис захворювань, які на сьогоднішній день вдалося зробити, і їх тепер можна дослідити.
Загалом моногенні хвороби - тобто коли поломки в якомусь гені призводять до захворювання - виявляються в ранньому дитячому віці. Більша їх частина – майже 90% – діагностуються у дитинстві. Менш 10% проявляється після статевого дозрівання і лише 1% – наприкінці репродуктивного періоду. Логіка зрозуміла: якщо відбувається якась поломка в генетичному матеріалі, перестає функціонувати якийсь білок, то зазвичай прояви цієї поломки видно з перших днів життя, а дуже часто навіть внутрішньоутробно. Але якщо все-все захворювання скласти, то - у разі моногенних захворювань, коли поломка в одному гені призводить до одного захворювання - частота їх проявів становить 0,36%. Скажу інакше: із тисячі людей лише чотирьом загрожує бути володарями генетичного захворювання. Але всі ці хвороби досліджуються докладніше. Що то за хвороби? У Росії її найчастіше зустрічаються наступні:
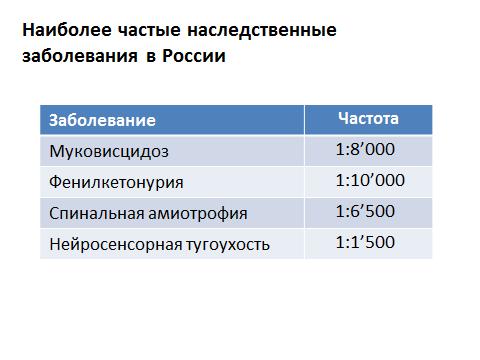
Для муковісцидозу: один хворий зустрічається на вісім тисяч людей. Для фенілкетонурії: один на десять тисяч. Тобто найчастіше захворювання - воно ж рідкісне. Але сумарно маємо досить велику цифру.
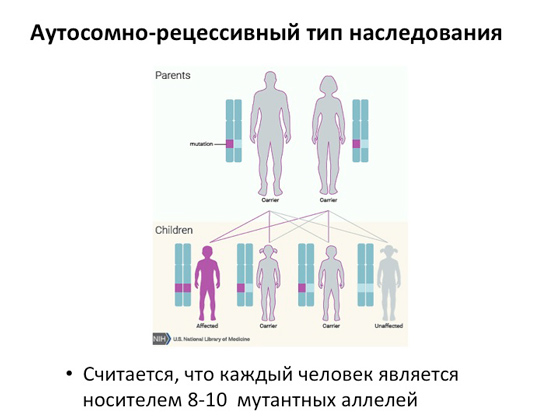
Кожен з нас має два набори хромосом: одні прийшли від тата, інші від мами. У разі аутосомно-рецесивного захворювання кожен із батьків може нести поломки гена в одній хромосомі - одна поломка в маминій, інша в татовій. Відповідно, коли в них народжуються діти, то можливі три варіанти: народжується хвора дитина, у якої поломки двох копій генів, народжується двоє дітей, і у кожного по одній поломці, або дитина, яка не має жодної поламаної копії гена. Тобто у разі аутосомно-рецесивного захворювання у потомстві лише одна дитина може мати обидві копії поламаних генів, внаслідок чого виникає захворювання. Вважається, що в середньому в популяції кожен з нас може бути носієм восьми чи навіть десяти мутантних алелів (тобто різних форм одного й того ж гена). Тобто ми можемо (не дай бог, звичайно) зустріти партнера, який матиме поломку в тому ж самому гені, і це призведе до того, що народжуватимуться діти за таким розподілом. Автосомно-рецесивний тип успадкування зустрічається майже у половини всіх генетичних захворювань людини.
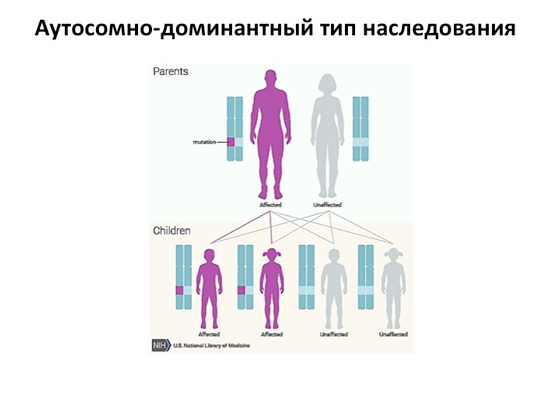
Другий варіант – аутосомно-домінантний тип успадкування. Тут картина ще простіша: досить поломки лише в одній копії гена, і виникає захворювання. Тому якщо ми маємо одного хворого батька, то це захворювання чітко успадковуватиметься з 50-відсотковою ймовірністю його дітьми. Чому тут одне спадкування, а там інше? Ну, ось так улаштовані гени. Іноді ген настільки важливий, що його недолік призводить до того, що захворювання виникає. А буває, що у дітей або самих батьків половина копій генів нормальна, половина з мутацією, але спрацьовує компенсаторний механізм, який допомагає організму з цим справлятися, і захворювання ніяк не розвивається.
Звідки беруться ці поламані гени з цими самими мутаціями? Зрозуміло, що ми маємо у своїх клітинах ДНК, і ДНК ця дуже велика. Три мільярди нуклеотидів! Відповідно, коли клітини діляться, хоч би як був точний процес поділу, виникають помилки. Незважаючи на те, що у нас у клітинах існують механізми, які стежать за тим, щоб помилок не було, і навіть репарують неправильні заміни, - все одно якась частина мутацій виникає і успадковується. І довгий час було незрозуміло: а як часто це відбувається, як це все влаштовано? І лише недавно - буквально останні кілька років - вийшло кілька дуже потужних наукових праць. Геноми здорових і хворих людей повністю секвенували, щоб можна було оцінити, як виникають нові мутації щодо першого покоління та другого, і виявилося, що в середньому від батька діти успадковують близько сорока нових змін. Тобто, у геномі батька цих змін немає, а у дитини вони з'являються. І, що найцікавіше, у тих роботах показано: що старше батько, то більше в його ДНК поломок передається потомству. До жінок це, до речі, не стосується. У середньому від матері дитині передається близько десяти-двадцяти замін, але це число не залежить від віку матері. Повторю ще раз. Сенс у тому, що якщо ми візьмемо двох абсолютно здорових людей і у них народиться дитина, то у малюка буде приблизно сорок нових замін від тата і двадцять нових замін від мами, тобто він матиме близько шістдесяти замін у геномі, яких у батьків немає . І зрозуміло, що ці шістдесят змін можу перебувати будь-де. Вони можуть бути в якихось важливих генах, а можуть бути в генах, які взагалі не мають сенсу. Але ймовірність того, що ці зміни все ж можуть пошкодити якийсь ген і виникне захворювання аутосомно-рецесивного типу або аутосомно-домінантного, є завжди. І з цим ми взагалі нічого зробити не можемо – так улаштована природа. І вона при цьому таки досить досконала. Ви тільки уявіть: три мільярди нуклеотидів подвоюються при розподілі клітини, і це все досить складний, великий процес, і лише сорок помилок можуть виникнути. Захворювання ці завжди були, є і будуть, і людству їх не позбутися. Але що найважливіше – і це те, чим медична генетика займається, на що спрямована – тепер у нас є ДНК-діагностика.
![]()
Навіщо діагностують генетичні захворювання? Насамперед, для того, щоб людина розуміла свою долю. Коли людина чимось хвора, знання і саме розуміння природи цього захворювання - як воно влаштоване, чому виникло - психологічно полегшують життя. Другий і найчастіше найважливіший момент: ДНК-діагностика потрібна у тому, щоб, скориставшись знанням, люди могли запланувати народження здорових дітей. І зараз я розповім про те, як це влаштовано.
Генетичних захворювань багато, і причин, через які вони виникають, також багато. Найперші дослідження цих причин виглядали дуже просто: все, що могли зробити вчені 50-60 років тому - це подивитися в мікроскоп і побачити, як влаштовані хромосоми людини. І сьогодні ми знаємо, що у людини 23 пари хромосоми. Усі аномалії щодо цієї норми вчені реєструють, і описують, і пов'язують з якимись генетичними захворюваннями. Ось картинка, в якій неважко розібратися, якщо уважно подивитися, що такого в ній неправильного.
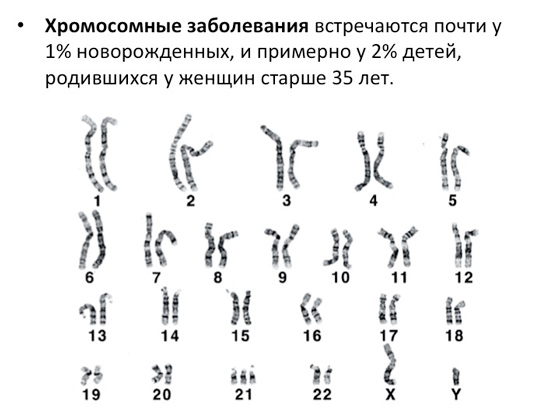
Легко помітити, що у 21-ї хромосоми три копії замість двох. Не помітити це у мікроскоп навіть студенту складно. І зрозуміло, що таке ось аномальне збільшення копій хромосом – як і, навпаки, зменшення – призводить до захворювання. Те саме, якщо хромосома має якусь надмірну довжину або стає коротшою. І звідси з'являються хромосомні захворювання. Вони є дуже великою групою - близько 1% новонароджених має такі патології (і близько 2% дітей народжується з хромосомними патологіямиу жінок старше 35 років; безумовно - так вже влаштована біологія - з віком деякі процеси починають працювати гірше, у тому числі ембріональний розвиток та багато іншого. Взагалі статистика хромосомних аномалій дуже цікаво влаштована. На 10 тисяч вагітностей, які статистично можна проаналізувати, ми маємо близько 9 тисяч з нормальними хромосомами та близько 800 випадків із патологіями. І серед цих 800 - ось так знову влаштована природа - лише 50 випадків призводять до того, що народжуються діти, якісь аномальні речі. Інші вагітності, як правило, завмирають, не розвиваються і закінчуються мимовільними викиднями. З одного боку це добре. Природа розуміє, що має бути нормальний набір хромосом, а якщо щось не так – хромосом стає більше, менше, губляться якісь важливі фрагменти, – на клітинному рівні запускаються процеси, які вагітність зупиняють. З іншого боку, у якихось випадках вагітність продовжується, незважаючи ні на що. Один із найвідоміших прикладів – трисомія 21-ї хромосоми, яка призводить до синдрому Дауна.
Звичайно, на сьогоднішній день існують різні способивсього цього уникнути. Мікроскопічний метод спостереження за кількістю та якістю хромосом, що існує дуже давно і дуже успішно, потихеньку витісняється більш сучасним та чутливим методом, який називається «мікроматричний аналіз».
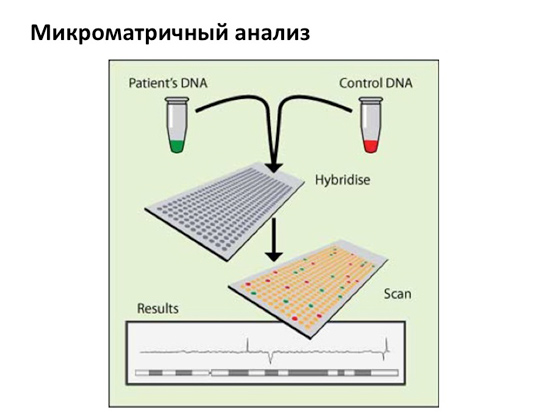
Я зовсім коротко змалюю, як він влаштований: беруться ДНК пацієнта та контрольна ДНК, хитрим чином готуються, флуоресцентно мітяться і на спеціальних матрицях гібридизуються, в результаті ми бачимо хромосоми та бачимо флуоресцентний сигнал, який надходить від різних фрагментів ДНК хворого. У деяких випадках сигнал зростає, і це означає, що тут виникають копії генів, в якихось, навпаки, зникає, і це означає, що якась ділянка в гені була, але зникла. Тобто в одному випадку виникає дуплікація, в іншому – делеція. Мікроматричний аналіз дуже чутливий, і за допомогою нього події, що відбуваються, можна розглянути з гранично високою точністю.
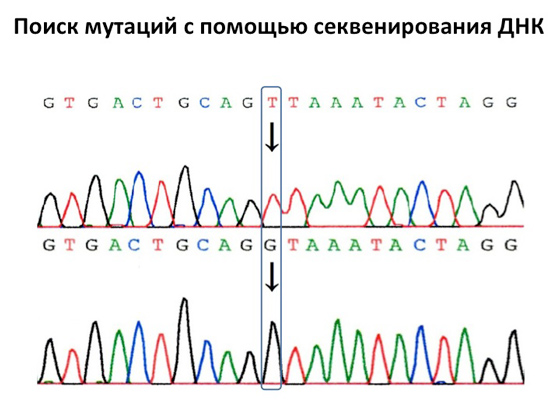
Однак основним методом діагностики було і залишається секвенування ДНК. Воно було винайдено в 1980 році чудовим вченим Фредеріком Сенгером, який вигадав, як можна визначати ті самі нуклеотиди, з яких складається наша ДНК. На сьогоднішній день такий аналіз поставлений на потік, його роблять практично у всіх ДНК-діагностичних лабораторіях світу. Робиться він дуже швидко, ефективно, з його можна досліджувати окремі ділянки генів. Грубо кажучи, це головна машина медичної генетики. Пошук мутацій генів за допомогою секвенування ДНК дуже простий: на виході отримуємо хроматограму, де за кожним сплеском сигналу стоїть якась конкретна буква. Коли ми секвенуємо ДНК хворого, то ми можемо виявити, що у здорової людини в одному місці буква Т, а у хворого в тому ж місці – буква Г. Знайти мутації в якихось конкретних генах – завдання нескладне. Головне – розуміти, де ці мутації дивитися.
Наступний крок розвитку ДНК-діагностики – масове паралельне секвенування. Винайдені такі потужні машини, які можуть відсеквенувати ваш геном весь і відразу, тобто всі хромосоми, всі гени за один аналіз будуть проаналізовані і розшифровані. Технологія ця з'явилася нещодавно і довгий час працювала недостатньо якісно. Сьогодні всі помилки усунуті, і масове паралельне секвенування є одним із найточніших та найдоступніших більшості людей аналізів. Зробити його може кожен – коштує це близько 30 тисяч рублів. Зараз машини для секвенування виглядають так:

Але найцікавіше, що вони, як очікують (і правильно роблять) вчені, будуть найближчим часом витіснені зовсім маленькими, дуже компактними міні-секвенаторами, які підключатимуться до USB-порту. На сьогоднішній день ця технологія тестується - поки, щоправда, робить багато помилок, - але очікується, що такий апарат коштуватиме всього близько 200 доларів і виглядатиме якось так:

Якоюсь мірою дуже добре, але в той же час і погано. Поява таких технологій, здатних до подібних аналізів, призвела до того, що в розвинених країнах - зокрема, в Англії та Нідерландах - бюджетні лікарні зробили такий аналіз обов'язковим для всіх, хто до них приходить. Причому неважливо, чи має людина генетичні захворювання чи ні: як тільки вона записалася на прийом до лікаря, їй одразу роблять секвенування геному. Це було запроваджено у 2011 році – тобто відносно нещодавно, – і зараз клінік, які практикують такий підхід, стає дедалі більше. І все було б чудово і здорово, але на руки лікар отримує різні літери - A, Т, Г, Ц, які можуть слідувати один за одним у різному порядку, і кількість цих літер у кожного з нас - близько трьох мільярдів штук.

Найскладніше завдання цього підходу (секвенування геному і його подальший аналіз) полягає в тому, щоб розшифрувати зміст цієї послідовності, інтерпретувати її, зрозуміти, де в ній є мутації, які викликають захворювання чи схильність до них, а де їх немає. Як тільки люди навчаться розуміти це розшифрування, «читати» цю анотацію, так одразу розпочнеться наступний етап розвитку медичної генетики. Але поки що цього не сталося, навряд чи буде корисним, якщо міні-секвенатори, так би мовити, увійдуть до наших будинків.
Усвідомлення цієї проблеми почалося з цих двох чудових людей. У 2007 році вийшли - паралельно і практично одночасно - дві роботи, в яких були просеквеновані персональні геноми Крейга Вентера і Джеймса Вотсона (так-так, того самого, який відкрив дволанцюжкову структуру ДНК, дійсно великого вченого; на знак того, що він так багато зробив для науки, йому було подаровано ось такий подарунок). Загалом, вийшли ці дві роботи з секвенування індивідуальних геномів людини, в яких вчені намагалися вичленувати сенс з цієї послідовності, і - нічого в них не вийшло. Тому що при аналізі було знайдено гени, які відповідають за конкретний фенотип (колір очей, колір волосся) або відповідальні за виникнення якихось захворювань, але за фактом цих проявів виявлено не було. Або, навпаки, у Вентера та Вотсона були захворювання та різні фізіологічні стани, але ніщо в «анотації» на них не вказувало. Виникла прірва. Начебто знаємо букви – A, Т, Г, Ц, але правильно інтерпретувати їхній сенс не вміємо. Прірва ця є досі. Чому? Тому що геном людини дуже великий, і якщо ми просеквенуємо ДНК будь-якого з нас, то в результаті отримаємо близько трьох мільйонів якихось індивідуальних відмінностей, які відрізнятимуть нас один від одного. Що й було свого часу зроблено з Вентером, Вотсоном та іншими невідомими людьми: коли їх відсеквенували, з'ясувалося, що 3,2 мільйона нуклеотидів відрізняють Вотсона від інших. І розібратися, чи важливі ці три мільйони і які особливості важливіші за інші, поки дуже і дуже складно. Навіть якщо брати не весь геном, не всю довгу послідовність ДНК, а розглядати лише значні ділянки, де містяться гени, з яких утворюються білки, які виконують якусь функцію. Таких ділянок у геномі близько одного відсотка. Сумарно у всіх них міститься від 30 до 70 тисяч геномних відмінностей. І розібратися, які впливають на роботу білка, а які не впливають, з погляду медичної генетики, поки що є дуже складним завданням. Робота потихеньку рухається, і знову-таки в цьому допомагає підхід, який був виявлений на початку медичної генетики, - аналіз родоводу хворого. Коли немає потреби порівнювати ДНК цієї конкретної людини з ДНК інших людей, а можна порівняти з ДНК родичів, тобто генетично близьких індивідуумів. Ось ДНК здорового брата, а ось хворого – яка різниця є між ними? У цьому випадку визначити причину захворювання стає набагато легше.
Подібні роботи на сьогоднішній день якраз є найуспішнішими. І ось одна з них: хлопчик хворів на невропатію, просеквенували геном батьків і геном хлопчика і за різницею того, що є у батьків, з тим новим, що знайшли у дитини, виявили мутацію в гені SLC26A3І стало зрозуміло, звідки це захворювання, навіть були запропоновані якісь способи його компенсувати.

99% генетичних захворювань невиліковні на сьогоднішній день. Ніяк ми поки що не можемо допомогти людям. І те, що медична генетика дає – це лише попередження захворювань. Я тут склав таку широко відому шараду - «лікувати не можна попередити», і зараз ми проговоримо все, що підходить під заголовок, який вийде з шаради, якщо кому поставити після другого слова. Тобто – «лікувати не можна, попередити». І як попереджають? Перший спосіб: ДНК-діагностика носійства мутацій. Ось цікавий випадок, який описує, наскільки цей метод є ефективним і правильним. Є таке генетичне захворювання Тея-Сакса – дуже важке, дуже рідкісне. У віці близько півроку у дітей виникає зупинка у психічному та фізичний розвиток, Поступово губляться зір, слух, здатність ковтати, дитина гине у віці приблизно чотирьох років. Відомо, що мутація, що викликає це захворювання, знаходиться у гені HEXA, що це аутосомно-рецесивний тип успадкування, тобто обидва батьки мають по поламану копію гена і дитина успадковує обидві поломки. Так вже влаштовано наше існування, що в якихось країнах, які живуть відокремлено та закрито, такі захворювання зустрічаються дуже часто. Загалом у випадку Тея-Сакса це Ізраїль. І саме євреї-ашкенази. Одна хвора дитина на три тисячі новонароджених. Захворювання тяжке, а Ізраїль – це держава, яка дбає про здоров'я нації. Тому на державному рівні було введено обов'язкове тестування на носія мутацій у гені HEXA, і буквально через кілька років в Ізраїлі стала народжуватися лише одна хвора дитина на багато сотень тисяч. Схожа історія була у Фінляндії, яка в останні 300 років поводилася дуже відокремлено, не сильно взаємодіючи зі світом, і це призвело до того, що окремі генетичні захворювання у фінів почали зустрічатися дуже часто. У них теж була введена скринінг-програма на носійство відразу кількох хвороб - і за дуже короткий строкїх усі найактивніше фактично елімінували.
Декілька років тому в Росії теж запустили програму під назвою «неонатальний скринінг». Тобто, як тільки народжується дитина, у неї з п'яти відразу беруть кілька крапель крові і проводять ДНК-діагностику на найчастіші в нашій країні генетичні захворювання: адреногенітальний синдром, галактоземію, вроджений гіпотиреоз, муковісцидоз, фенілкетонурію. Робиться це все для того, щоб на ранніх етапах зрозуміти, як можна допомогти людині максимально компенсувати патогенний ефект, не дати їй розвинутися.
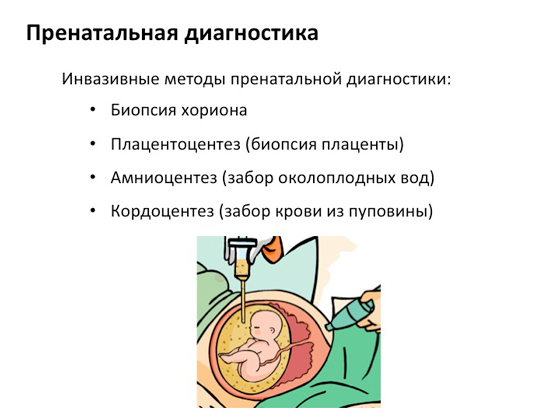
Наступний варіант діагностики – пренатальна діагностика. На ранніх термінах вагітності акуратно, не пошкодивши ні плід, ні внутрішні органи матері, беруть деякі частини хоріону, тобто оболонки плода, за якими роблять генетичний аналіз майбутній дитині, щоб зрозуміти, чи вона несе якісь поломки у своїх генах. Якщо з'ясовується, що поломки є, матері надається вибір: перервати вагітність або продовжити. Це дуже важливо – пропонується вибір. Саме так влаштовано генетичне консультування: не існує жодних суворих правил, людина сама вирішує, як їй із цим існувати.
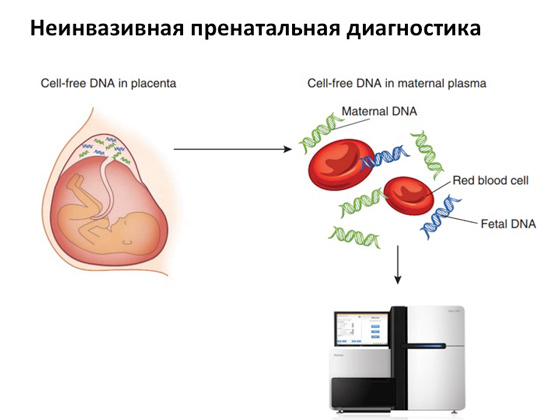
Завдяки появі потужних секвенаторів є неінвазивна пренатальна діагностика. Влаштована вона дуже цікаво. На ранніх термінах вагітності – наприклад, на термін у десять тижнів – у матері беруть кров із вени. Відомо, що в ході розвитку плода якісь його клітини відмирають, ДНК їх кришиться та потрапляє у кровотік матері. І якщо взяти у матері кров та скористатися потужним секвенатором, то за допомогою спеціальних алгоритмів можна ідентифікувати, яка ДНК материнська, а яка плода, та побачити, чи є в геномі плода якісь заміни, мутації. І якщо мутації є, то матері знову ж таки надається вибір.
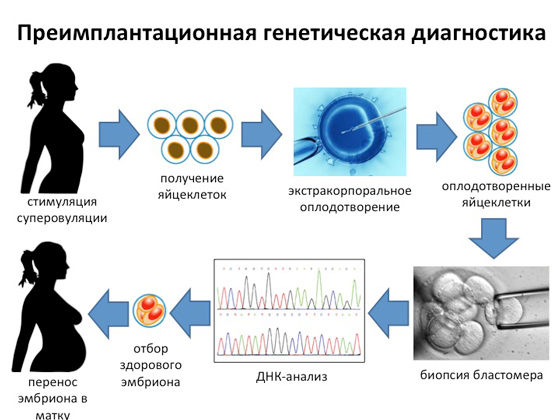
Вінцем усіх праць генетиків на сьогодні є так звана преімплантаційна генетична діагностика. Вона з'явилася зовсім недавно, є найскладнішим, найважчим і найдорожчим діагностичним методом, але дозволяє отримати здорову на сто відсотків дитину в переважній більшості випадків. Відразу обмовлюся, така діагностика потрібна лише в тих випадках, коли в лабораторію приходить подружня пара і каже: ось у нас перша дитина народилася з таким генетичним захворюванням, але ми хочемо, щоб наступний обов'язково був здоровим. Генетики проводять аналіз усієї сімейної історії, вичленюють ген із конкретною мутацією і розуміють, що потрібно робити, щоб цієї мутації у майбутньої дитини не було. Як це відбувається? У жінки викликають суперовуляцію, в результаті якої одержують якусь кількість яйцеклітин. Після цього у лабораторних умовах проводиться екстракорпоральне запліднення. Через кілька днів із запліднених яйцеклітин без будь-якої шкоди для майбутнього ембріона відбирають одну-єдину клітину, по якій проводять генетичну діагностику. І якщо вдається отримати інформацію про те, що в даної заплідненої яйцеклітини на стадії бластомера немає ніяких мутацій, то саме ця яйцеклітина підсідає матері, яка через дев'ять місяців дасть здорове потомство.
Медична генетика розробила багато різних підходів, що дозволяють створити умови, в яких можна уникнути виникнення генетичних захворювань, але, звичайно ж, у разі нових мутацій, що призводять до виникнення спадкових захворювань, ми не можемо нічого прогнозувати. Внаслідок цього народжуються хворі діти. І розуміння того, що їх треба лікувати (раз уже не змогли попередити), - це дуже актуальне завдання. І наука рухається і в цей бік також. Головна проблема полягає в тому, що йдеться про вісім тисяч захворювань. Розробити якийсь універсальний підхід, який дозволив би у будь-якому разі вилікувати все, неможливо навіть суто теоретично. Тому для кожного випадку генетики винаходять індивідуальні рішення, індивідуальні технології.
![]()
Ось тут наведена діаграма, на якій вказані різні терапевтичні стратегії, що застосовуються для спроб лікування генетичних захворювань обміну речовин. Видно, що у якихось випадках застосовують хірургію, у якихось – тканинну трансплантацію чи трансплантацію кісткового мозку. Один відсоток займає генна терапія, коли здійснюється доставка здорової копії гена. У якихось випадках намагаються обмежувати хворобу дієтою чи прийомом лікарських препаратів. Загалом підходів багато.
Щодо дієти, то в деяких випадках вона усуває захворювання практично повністю. Два широко відомих захворювання - галактоземія та фенілкетонурія. Перше – це порушення вуглеводного обміну, коли фермент, який засвоює молочний цукор, мутувавши, перестає його розщеплювати. Але коли народжується дитина, вона, зрозуміло, харчується виключно материнським молоком. І в цьому випадку невсвоєння молока потихеньку призводить до того, що починають розвиватися різні патології – зокрема, шлунково-кишкові проблеми, цироз печінки, катаракти. Все це відбувається буквально протягом перших тижнів і, на жаль, досить часто призводить до смерті. Тим часом лише за допомогою видалення молока з раціону дитини можна зробити так, що це вроджене генетичне захворювання не виявлятиметься. Те саме з фенілкетонурією - захворюванням, яке входить у пренатальний скринінг у Росії. Фермент, відповідальний за метаболізм амінокислоти фенілаланіну, мутувавши, перестає працювати. Але якщо прибрати з їжі продукти, які містять цей самий фенілаланін (у тому числі деякі горіхи, гриби, деякі молочні продукти), дитина розвиватиметься здоровою. Однак таких історій про дієти зовсім небагато, на пальцях перерахувати. Вчені намагаються для кожного хворого підібрати харчування, щоби якось полегшити його існування. Але всі захворювання різні, і мутації не завжди призводять до того, що ген зламався і не працює більше. Іноді функція білка зламана частково і він працює не так ефективно, тому достатньо десь дещо злегка компенсувати - і ефект значний.
Ймовірно, що саме в Китаї буде зроблено – якщо вже не зроблено кулуарно, що теж всі обговорюють – «відредагована» людина.
У цілому нині методи терапії спадкових захворювань можна розбити дві групи. Перша – за рахунок низькомолекулярних сполук, коли можна підібрати якусь таблетку, яка компенсує існуючі поломки. Незважаючи на те, що ми всі звикли пити таблетки, у випадку зі спадковими захворюваннями це дуже рідко працює. А ось те, що має чисто теоретично завжди працювати – і у випадку з генетичними поломками насамперед, – це використання різних молекулярних методів, куди зараз і рухається вся медична генетика. Найцікавіше, що для того, щоб використати всі ці підходи, існує цілий арсенал різних варіантів. Є методи, які дозволяють активувати роботу якихось конкретних генів: ген не працює, і ми можемо зробити так, щоб він у цій клітині активно запрацював. Або, навпаки, працює мутантний ген, виробляє токсичні продукти, але існують підходи, які можуть придушити його роботу селективно, спрямовано, щоб саме він серед усього генного різноманіття перестав працювати.
Найостанніше і найцікавіше, що народилося в генетиці буквально п'ять років тому, - це редагування мутантної копії гена. Підходи, що дозволяють виправити мутацію. Я розповім про це і про те, куди це все рухається, але спершу нагадаю постулат, який усім нам, за ідеєю, відомий, – центральну догму молекулярної біології. Пам'ятаєте, я розповідав про великого вченого Джеймса Вотсона? Так от, у нього був друг - Френсіс Крік, з яким вони разом відкрили дволанцюжкову структуру ДНК. Потім Вотсон почав займатися одними речами, а Крик - іншими (хоча обидва працювали в галузі молекулярної біології). Але так чи інакше саме Крик сформував на основі структури молекули ДНК цю центральну догму: у нас є ДНК, з неї виходить РНК, з неї виходить білок, який є вінцем усієї цієї історії, який далі якось функціонує, виконує якісь функції . На сьогоднішній день описано безліч білків, пояснено, як вони влаштовані, які у них є частини, що відповідають за функціонування. Навіщо все це описується? Для того, щоб потім побудувати таку величезну генну мережу.
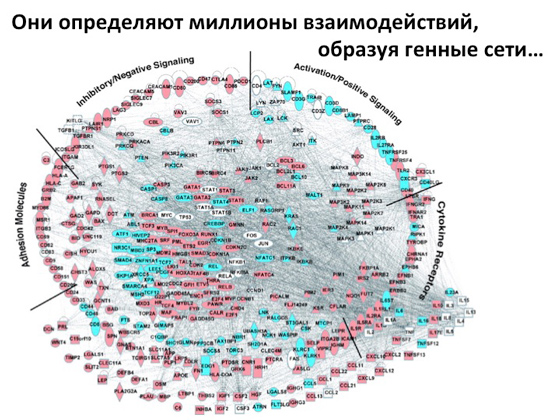
Ми розуміємо, які процеси, з якими генами пов'язані, як ці процеси запускаються, як передаються сигнали з одного місця в інше, як вони регулюються. Ми розуміємо, як застосовувати всі ці підходи, щоб якийсь ген вимкнути, а якийсь увімкнути. Тобто якщо виникла мутація в гені, це не означає, що все, кінець, ми не можемо нічого зробити. Ні, ми можемо зрозуміти, який обхідний шлях активувати, щоб налагодити нормальне існування клітини, нормальний метаболізм. Або – навпаки – який шлях придушити. І фундаментальна наука тут дуже потрібна, щоб ці знання далі можна було використовувати в генетиці для лікування спадкових захворювань. Але чому так складно застосовувати ці підходи? Тому що людина – це багатоклітинний організм. Те, яким ви мене зараз бачите, - це мільярди клітин, кожна має свою програму, і всі займаються якимись своїми функціями. У мозку одні клітини, у м'язах інші. І це все дуже складно влаштовано, тому, якщо я маю намір втрутитися в якийсь процес, мені потрібно буде дістатися не всього організму в цілому, а саме тих клітин, які реалізують конкретний фенотип. Якщо хворий страждає від судом, значить, у нейронах відбувається погана передача сигналів, і мені немає необхідності втручатися в роботу всіх клітин, мені потрібно дістатися клітин мозку. Відповідно адресна доставка - найскладніше завдання, яке стоїть сьогодні перед вченими. Вона легко реалізується, коли є якийсь конкретний орган, який добре ізольований, куди можна все доставити без будь-яких проблем. Найпростіший приклад – це око. Так уже заведено природою, що він такий доступний, такий ізольований - і роби з ним що завгодно. І досить багато чого з ним уже роблять – зокрема застосовують генну терапію, коли можна якісь процеси підкрутити чи, навпаки, придушити. Але є й інший добре доступний орган – шкіра. Здавалося б, ось вона, але - не вдається доставити туди матеріали, тому що шкіра має захисний бар'єр, що не дозволяє, щоб туди потрапляла будь-яка нісенітниця.
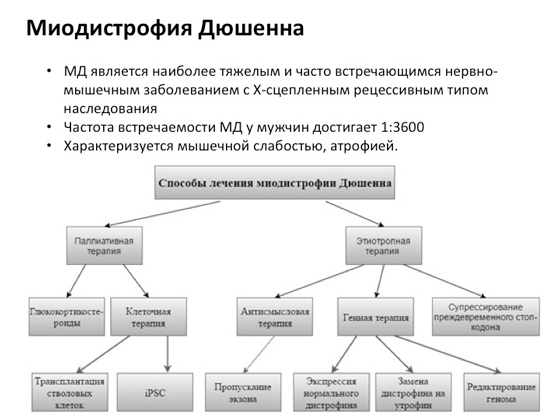
Є, наприклад, таке захворювання - міодистрофія Дюшенна, дуже поширене. Щоб його лікувати, вчені розробляють різноманітні підходи. І бачите, тут не один підхід, над яким вчені працюють багато років, а багато підходів. Десь пробують клітинну терапію – хворому доставляють нові клітини, щоб зрозуміти, буде йому краще чи не буде. Десь додають різні лікарські сполуки. У когось виходить краще, у когось не виходить зовсім. Один із останніх варіантів: вчені розробили спеціальну хімічну речовину, яка дозволяє уникати мутацій, що викликають появу так званих стоп-кодонів. Що це таке? У якихось випадках мутація призводить до того, що рибосома, коли рухається РНК і синтезує білок, доходить до стоп-кодону, що виникає за рахунок мутації, і в результаті виходить укорочений білок замість нормального, великого. Укорочений білок не може нормально працювати. І вчені придумали таку речовину, яка допомагає рибосомі під час руху молекулою РНК перестати розпізнавати ці стоп-кодони, в результаті виходить довгий продукт. Це насправді дуже велике досягнення - і сталося воно зовсім недавно.
Проте, попри все, основна історія, яку всі дуже розраховують, - це генна терапія. Коли ми можемо копію гена, яка не несе жодних мутацій, якимось чином доставити до клітини з мутантним геном. І тому існує так званий вірусний спосіб доставки. Тобто ті самі віруси, від яких ми хворіємо, спеціальним чином модифікують, прибирають усі непотрібні компоненти, залишають лише структурну частину та використовують як транспорт для доставки нормального гена людини. Ідею цю вигадали дуже давно, і сьогодні її намагаються реалізувати в багатьох країнах одночасно. Декілька тисяч випробувань зараз відбувається у всьому світі.
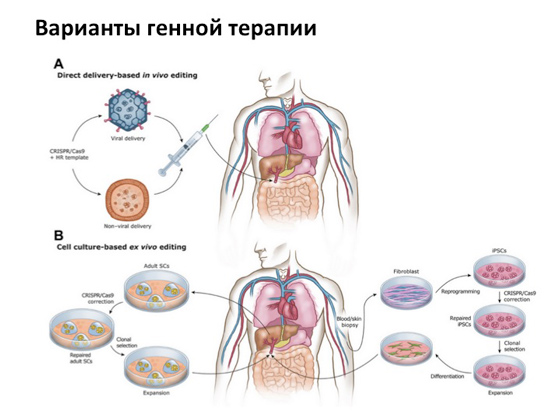
Насамкінець я вам розповім кілька вдалих історій. Перша пов'язана із захворюванням, яке називається синдромом дефіциту аденозиндезамінази. Можливо, ви чули про фільм «Хлопчик з міхура» (або навіть дивилися його) - про те, як жив-був хлопчик, весь час перебував у міхурі, мама його берегла, а він втік з дому і побачив, який світ прекрасний . Ця історія ґрунтується на реальних подіях. Хлопчика звали Девід Веттер, він мав саме таке генетичне захворювання, пов'язане, по суті, з важкою формою імунодефіциту. Грубо кажучи, дитина могла загинути від будь-якої інфекції. І коли стало зрозуміло, що він такий хворий, його ізолювали від усього зовнішнього світу в кімнатах, де він прожив досить довго. Його постійно намагалися лікувати різними методами, різними препаратами. У нього була сестра, від якої йому робили пересадку кісткового мозку, але це не допомогло. Історія загалом сумна: хлопчик помер, не доживши трохи до того моменту, коли генна терапія була успішно застосована до лікування цього захворювання. Виглядає це наступним чином: від хворого беруть клітини кісткового мозку, які відповідають за виробництво імунних клітин, за допомогою вірусу доставляють у них копію гена і потім клітини підсаджують назад хворому. В результаті людина отримує новий, скажімо, кістковий мозок з копією нормального гена. Історія ця була вперше реалізована у 1990 році.
Ще одна історія стосується вродженого амаврозу Лебера - це дегенерація сітківки ока, що досить рідко зустрічається і виникає через мутацію в певному гені, що кодує білок, який відповідає за пігментний епітелій сітківки. Було розроблено спеціальні вірусні частки, у яких була нормальна копія гена RPE65, і хворим, які страждають на це захворювання, були зроблені ін'єкції препарату прямо в око. В результаті хворі, що втратили зір або навіть з народження його не мали, знову його при лікуванні. Минулого року цей генний препарат був схвалений спеціальним комітетом FDA, і його повинні ось-ось запустити у масове використання.
Таких історій чимало, але спадкових захворювань, як пам'ятаєте, дуже багато, близько восьми тисяч.
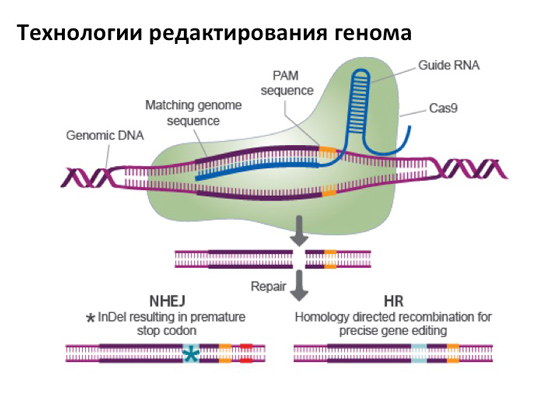
Насамкінець, звичайно, мені дуже хочеться хоч пару слів сказати про таку чудову технологію, як редагування геному. Вона справила цілковитий фурор у науці. Суть цього редагування в наступному: є певного роду білок, який має нуклеазну активність, тобто може розщеплювати ДНК, а за рахунок однієї хитрої РНК ми можемо програмувати роботу білка так, щоб він розривав ДНК у якомусь конкретному місці. А далі можливі два варіанти. Для нас зараз важливим є один із них: коли білок розірве ДНК у заздалегідь запланованому місці, що містить мутацію, можна активувати механізми клітинної репарації, що дозволяють розрив відновити так, що виникне нова копія гена, яка не нестиме мутацію. І створення такого роду білків, які специфічно можуть бути кудись спрямовані, у певні гени, - це дуже важливий крок. І при цьому дуже простий та зручний метод: будь-який студент у добре оснащеній лабораторії може з цим впоратися за лічені місяці. Тому зараз виходить багато публікацій про те, де і коли цю технологію застосовують, і зрозуміло, що насамперед її намагаються застосувати для лікування різних генетичних захворювань. І поки, судячи з науковим статтям, все йде добре. Нещодавно я читав статтю в журналі Nature, в якій аналізувалося, як у різних країнахна сьогоднішній день влаштовані законодавчі акти і де вперше має з'явитися «відредагована» людина – неважливо, із суперздатностями або просто вилікувана від якогось захворювання. Якщо не вдаватися до подробиць, то абсолютно всі країни це не підтримують. Але питання у тому, наскільки це глибоко проговорено на законодавчому рівні. Загалом, у статті йдеться про те, що одна з потенційних країн, в якій всі ці моменти проговорені менш чітко, - це Китай. Причому, якщо раніше вважалося, що Китай - відстала в науковому плані країна, то зараз вони нас обігнали так, що їх уже й не наздогнати, особливо в біології. Китайці вкладають у цю величезну кількість грошей. Вони приваблюють спеціалістів з усього світу, своїх посилають навчатися, а потім беруть назад та дають їм лабораторії, інститути. Вони дуже активно у цьому напрямі розвиваються. Ймовірно, саме в Китаї буде зроблено – якщо вже не зроблено кулуарно, що теж всі обговорюють, – «відредагована» людина. І найперша історія, яку довго не могли опублікувати, була про те, що вже демонстрували метод редагування геному на людських ембріонах. Нічого страшно там не було, все добре і правильно було зроблено, ембріони людини не могли розмножуватися далі і були взяті як модельний об'єкт. Загалом експеримент показав, що при редагуванні поки виникає багато помилок. Як це прийнято в науковій спільноті, будь-яка новина такого роду найактивніше дискутується: з одного боку, всі розуміють - так, всі ці технології, що тільки-но з'явилися, годяться для вирішення різних завдань. З іншого боку, побічні ефекти, які можуть виникнути, ніхто не може передбачити. І тому вчені дуже акуратно, крок за кроком роблять спроби все це перевірити та дослідити. Я дуже не хочу даремно обнадіювати, але, як мені здається, у найближчі десять-двадцять років у нас точно з'являться надійні засоби для лікування генною терапією. А поки що маємо те, що маємо.
Записала Наталія Кострова